আইসোথার্মাল(Isothermal):
সাধারণভাবে, একটি আইসোথার্মাল প্রক্রিয়া চলাকালীন অভ্যন্তরীণ শক্তি, তাপ শক্তি এবং কাজের পরিবর্তন হয়। যদিও তাপমাত্রা একই থাকে। সিস্টেমের মধ্যে কিছু সেই সমান তাপমাত্রা বজায় রাখতে কাজ করে। একটি সাধারণ আদর্শ উদাহরণ কারনোট সাইকেল, যা মূলত বর্ণনা করে যে একটি তাপ ইঞ্জিন কীভাবে একটি গ্যাসকে তাপ সরবরাহ করে কাজ করে। ফলস্বরূপ, গ্যাস একটি সিলিন্ডারে প্রসারিত হয় এবং এটি কোনও কাজ করতে পিস্টনকে ধাক্কা দেয়।
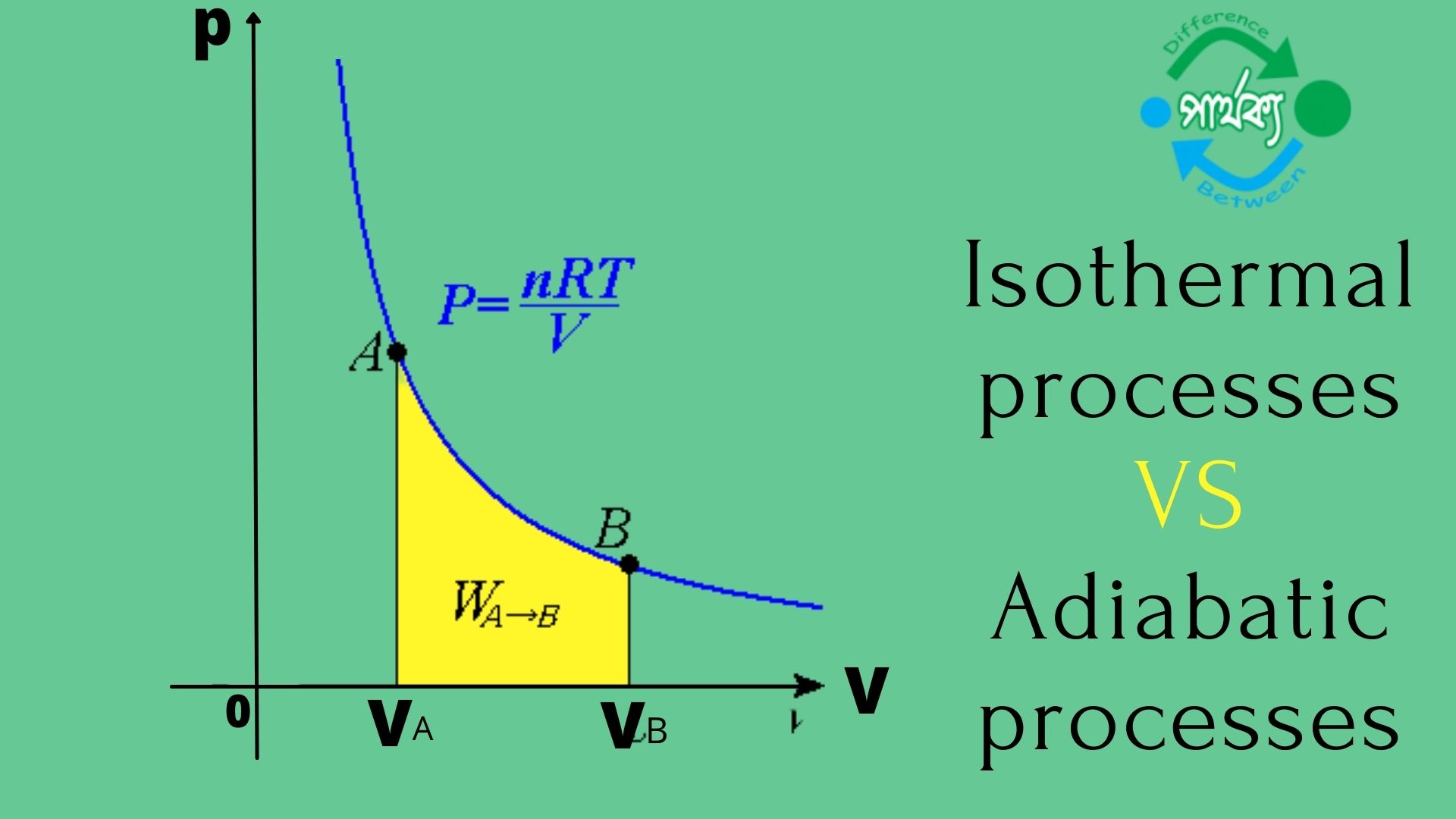
একটি আইসোথার্মাল প্রক্রিয়া একটি থার্মোডিনামিক প্রক্রিয়া। এই আইসোথার্মাল প্রক্রিয়াতে, সিস্টেমের তাপমাত্রা পুরো প্রক্রিয়া জুড়ে স্থির থাকে। যদি আমরা তাপমাত্রাকে টি বলে বিবেচনা করি তবে তাপমাত্রার পরিবর্তনটি ΔT। আইসোথার্মাল প্রক্রিয়াটির জন্য, আমরা বলতে পারি যে ΔT = 0
আদর্শ গ্যাসের আইসোথার্মাল সম্প্রসারণ
(i) সমতাপক - তাপমাত্রা স্থির থাকে।
(ii) সম্প্রসারণ - আয়তন বাড়ছে।এর অর্থ হ’ল আইসোথার্মাল প্রসারণ সিস্টেমের ধ্রুবক তাপমাত্রার সাথে ভলিউম বৃদ্ধি করে।
এই অবস্থায় গ্যাস করছে কাজ, সুতরাং কাজটি নেতিবাচক হবে কারণ গ্যাস ভলিউম বৃদ্ধির জন্য শক্তি প্রয়োগ করে।
অভ্যন্তরীণ শক্তির পরিবর্তনও শূন্য ΔU = 0

অ্যাডিয়াব্যাটিক (Adiabatic):
থার্মোডিনামিক্সের প্রথম আইন মেনে চলার প্রক্রিয়াটি প্রসারণ বা সংক্ষেপণের সময় ঘটে থাকে যেখানে সিস্টেম থেকে আশেপাশে কোনও তাপের বিনিময় হয় না, এটি অ্যাডিয়াব্যাটিক প্রক্রিয়া হিসাবে পরিচিত হতে পারে। আইসোথার্মাল প্রক্রিয়া থেকে পৃথক, অ্যাডিয়াব্যাটিক প্রক্রিয়া কাজের আকারে আশেপাশে শক্তি স্থানান্তর করে। এটি হয় বিপরীতমুখী বা অপরিবর্তনীয় প্রক্রিয়া হতে পারে।
বাস্তবে, কোনও শারীরিক প্রক্রিয়া স্বতঃস্ফূর্তভাবে ঘটতে পারে না এবং কোনও সিস্টেমকে পুরোপুরি উত্তাপিত করা যায় না বলে একটি নিখুঁত অ্যাডিয়াব্যাটিক প্রক্রিয়া কখনই পাওয়া যায় না। একটি সিস্টেমের আচরণের একটি ভাল প্রথম অনুমান গণনা করার জন্য adiabatic বিচ্ছিন্নতার অনুমান দরকারী এবং প্রায়শই এই জাতীয় আদর্শের সাথে মিলিত হয়। উদাহরণস্বরূপ, ল্যাপ্লেসের মতে , যখন শব্দ একটি গ্যাসে ভ্রমণ করে, তখন মাধ্যমটিতে তাপ সঞ্চালনের জন্য কোন সময় থাকে না, এবং তাই শব্দের প্রসারণ হয় adiabatic। এই ধরনের একটি adiabatic প্রক্রিয়ার জন্য, স্থিতিস্থাপকতার মডুলাস ( ইয়াং’স মডুলাস ) E = γP হিসাবে প্রকাশ করা যেতে পারে , যেখানে γ হল ধ্রুব চাপে এবং ধ্রুব আয়তনে নির্দিষ্ট তাপের অনুপাত ( γ = C p / C v ) এবং P গ্যাসের চাপ।
একটি বদ্ধ সিস্টেমের জন্য, কেউ তাপগতিবিদ্যার প্রথম সূত্রটি লিখতে পারে : Δ U = Q – W , যেখানে Δ U দ্বারা সিস্টেমের অভ্যন্তরীণ শক্তির পরিবর্তন বোঝায়, Q তাপ হিসাবে এতে যোগ করা শক্তির পরিমাণ এবং W কাজটি সম্পন্ন হয়। তার আশেপাশে সিস্টেম দ্বারা.
আইসোথার্মাল এবং অ্যাডিয়াব্যাটিক প্রক্রিয়ার মধ্যে পার্থক্য:
সাধারণভাবে, একটি আইসোথার্মাল প্রক্রিয়া চলাকালীন অভ্যন্তরীণ শক্তি, তাপ শক্তি এবং কাজের পরিবর্তন হয়। আইসোথার্মাল এবং অ্যাডিয়াব্যাটিক প্রক্রিয়ার মধ্যে পার্থক্য নিম্নরূপ-
১। একটি আইসোথার্মাল প্রক্রিয়া একটি থার্মোডাইনামিক প্রক্রিয়া যা একটি ধ্রুবক তাপমাত্রার অধীনে ঘটে। অন্যদিকে অ্যাডিয়াব্যাটিক প্রক্রিয়া একটি থার্মোডাইনামিক প্রক্রিয়া যা কোনও সিস্টেম এবং তার চারপাশের মধ্যে কোনও তাপ স্থানান্তর ছাড়াই ঘটে।
২। আইসোথার্মাল প্রক্রিয়াগুলিতে তাপ স্থানান্তর লক্ষ্য করা যায়। অন্যদিকে অ্যাডিয়াব্যাটিক প্রক্রিয়াগুলিতে কোনও তাপ স্থানান্তর হয় না।
৩। তাপমাত্রা আইসোথার্মাল প্রক্রিয়াগুলির জন্য ধ্রুবক। অন্যদিকে তাপমাত্রাটি অ্যাডিয়াব্যাটিক প্রক্রিয়াগুলিতে পরিবর্তিত হতে পারে।
৪। আইসোথার্মাল প্রক্রিয়াগুলিতে, সিস্টেমের নেট হিট কনটেন্টের পরিবর্তনের কারণে কাজটি সম্পন্ন হয়। অন্যদিকে অ্যাডিয়াব্যাটিক প্রক্রিয়াগুলিতে, কাজটি তার অভ্যন্তরীণ শক্তির পরিবর্তনের কারণে ঘটে।