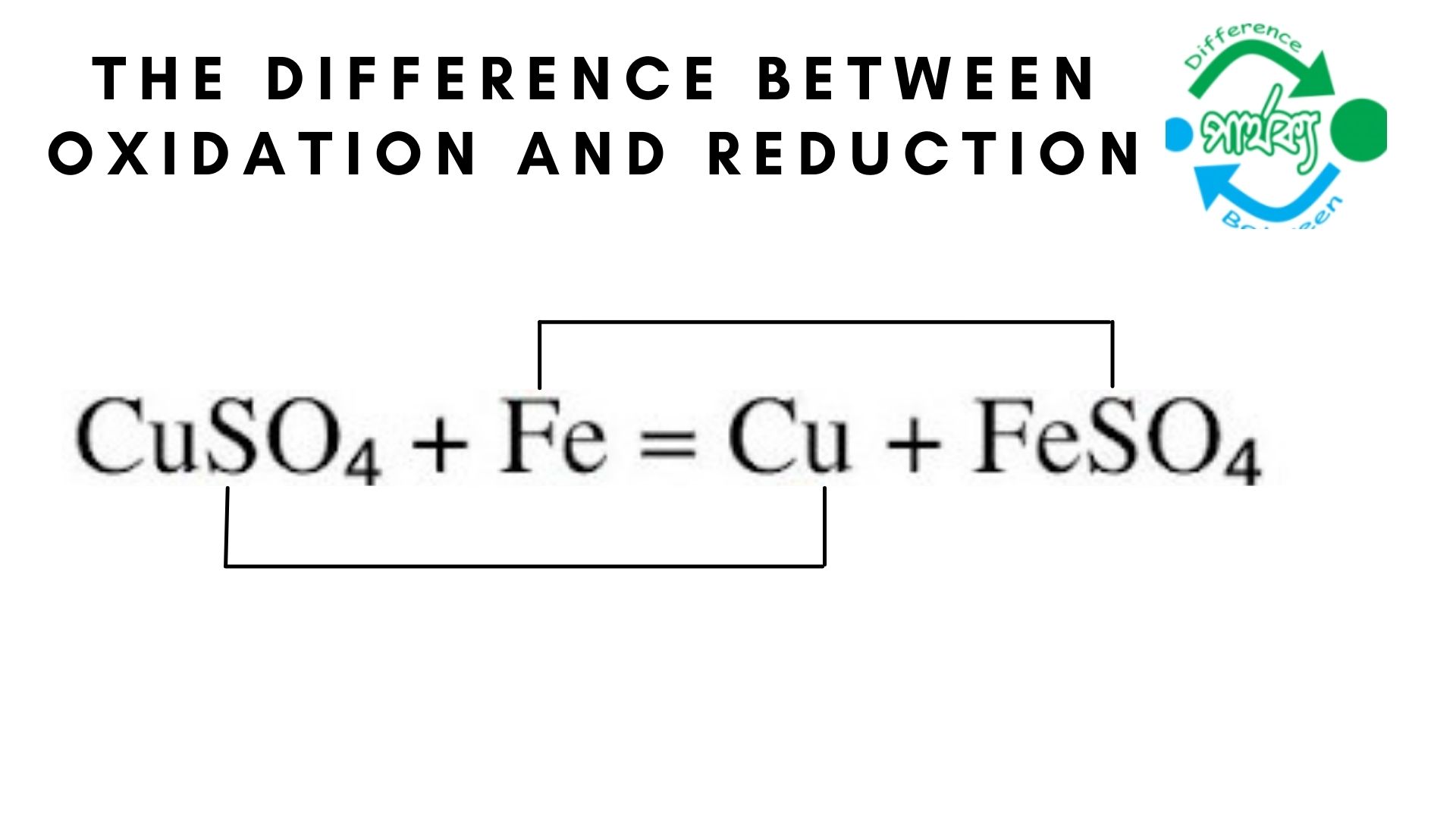জারণ(Oxidation):
জারণ হলো এক প্রকারের বিক্রিয়া যাতে কোনো রাসায়নিক সত্তা (অণু, পরমাণু, মূলক বা আয়ন) ইলেকট্রন প্রদান করে। জারণ বিক্রিয়ায় অংশগ্রহণ করে যে সত্তা তাকে বিজারক ও যার দ্বারা জারণ সংঘটিত হয় তাকে জারক বলে। যেমন-
2H2(g) + O2 (g) → 2H2 O (l)
2Mg(s) + O2(g) → 2MgO(s)
4P(s) + 5O2 (g) → 2P2 O5(s)
2CO(g) + O2 → 2CO2(g)
2SO2(g) + O2 → 2SO3(g)
অথাৎ H2 , Mg, P, CO I জারিত হয়ে যথাক্রমে H2 O, MgO, P2 O5 , CO2 I SO3 উৎপন্ন করেছে। পরবর্তী সময়ে এই সংজ্ঞাকে আরও ব্যপকতর করার জন্য কোন মৌল বা যৌগে অক্সিজেন বা অক্সিজেনের ন্যায় কোন তড়িৎ ঋণাত্মক মৌল বা মূলকের সংযোগ কিংবা কোন যৌগ থেকে হাইড্রোজেন বা হাইড্রোজেনের ন্যায় কোন তড়িৎ ঋণাত্মক মৌল বা মূলকের অপসারণকে জারণ হিসেবে সংজ্ঞায়িত করা হয়।
বিজারণ(Reduction):
যে রাসায়নিক বিক্রিয়ায় কোন মৌল যৌগ থেকে অক্সিজেন অপসারিত হয় হাইড্রোজেন যুক্ত হয় তাকে আমরা বলি বিজারণ বা Reduction. যেমন-
Cl2 + H2 → 2HCl
N2 + 3H2 → 2NH3
পরে এই সংজ্ঞাকে আরও ব্যপকতর করা হয়। কোন মৌল বা যৌগে হাইড্রোজেন বা হাইড্রোজেনের ন্যায় কোন তড়িৎ ঋণাত্মক মৌল বা মূলকের সংযোগ কিংবা কোন যৌগ থেকে অক্সিজেন বা অক্সিজেনের ন্যায় কোন তড়িৎ- ঋণাত্মক মৌল বা মূলকের অপসারণকে বিজারণ হিসেবে সংজ্ঞায়িত করা হয়। যথা-
HgCl2 + Hg → Hg2 Cl2
CuO + H2 → Cu + H2 O
ZnO + C → Zn + CO
FeCl3 + [H] → FeCl2 + HCl ( বিজারণ বিক্রিয়া)
জারণ ও বিজারণের মধ্যে পার্থক্য:
জারণ হলো এক প্রকারের বিক্রিয়া যাতে কোনো রাসায়নিক সত্তা (অণু, পরমাণু, মূলক বা আয়ন) ইলেকট্রন প্রদান করে। জারণ ও বিজারণের মধ্যে পার্থক্য নিম্নরুপ-
১.জারণ বিক্রিয়ায় ইলেকট্রন ত্যাগ হয়। অন্যদিকে বিজারণ বিক্রিয়ায় ইলেকট্রন গৃহিত হয়।
২.জারণ বিক্রিয়ায় অক্সিজেন বা তড়িৎ ঋনাত্মক মৌলের সংযোগ হয়। অন্যদিকে বিজারণ বিক্রিয়ায় অক্সিজেন বা তড়িৎ ঋনাত্মক মৌলের অপসারণ হয়।
৩.জারণ বিক্রিয়ায় হাইড্রোজেন বা তড়িৎ ধণাত্মক মৌলের অপসারণ হয়। অন্যদিকে বিজারণ বিক্রিয়ায় হাইড্রোজেন বা তড়িৎ ধণাত্মক মৌলের সংযোগ হয়।
৪.জারণ বিক্রিয়ায় জারণ সংখ্যার বৃদ্ধি ঘটে। অন্যদিকে বিজারণ বিক্রিয়ায় জারণ সংখ্যার হ্রাস ঘটে।
৫.যে জারণ ঘটায় তাকে বলে বিজারক। অন্যদিকে যে বিজারণ ঘটায় তাকে জারক বলে।
৬.জারণঃZn→Zn^(2+) +2e^(-). অন্যদিকে বিজারণঃCu^(2+) +2e^(-) →Cu.