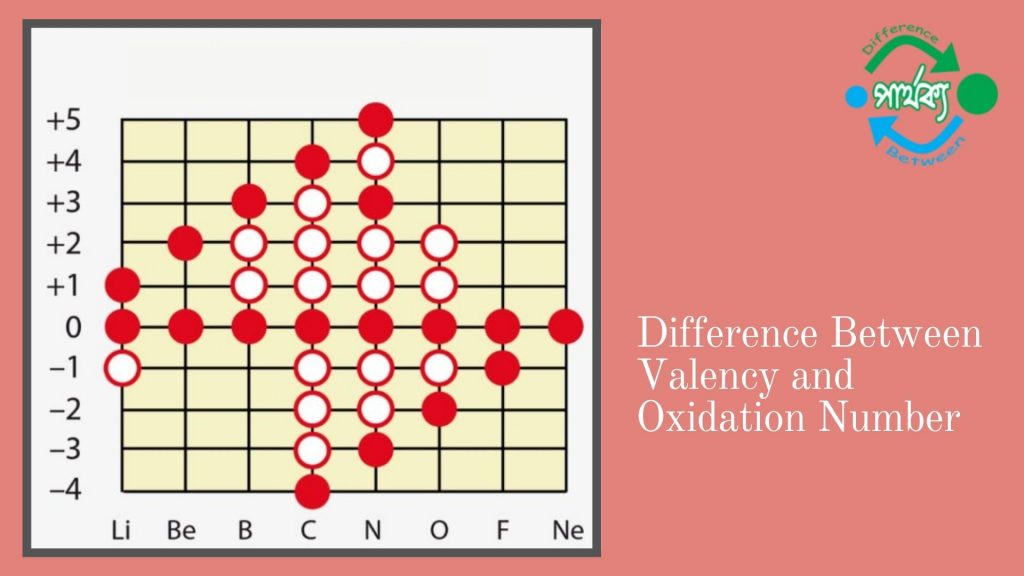
যোজনী (Valency):
অণু গঠনকালে কোনো মৌলের একটি পরমাণুর সাথে অপর একটি মৌলের কোনো পরমাণু যুক্ত হবার সামর্থ্যকেই যোজনী বলে। আবার অন্যভাবে বলা যায়, কোন মৌলের একটি পরমানু যতগুলো হাইড্রোজেন(H) অথবা তার সমতুল্য (যেমনঃ- ক্লোরিন(Cl), সোডিয়াম(Na) ইত্যাদি) অন্য মৌলের যত সংখ্যক পরমাণুর সাথে সংযুক্ত হতে পারে তাকে যোজনী বলে। হাইড্রোজেনের যোজনী সবসময় ১ ধরা হয়। অন্যদিকে ক্লোরিনের একটি পরমাণু হাইড্রোজেনের একটি পরমাণুর সাথে মিলে HCl গঠন করে বলে ক্লোরিনের যোজনীও ১, কেননা এটি কেবল একটি হাইড্রোজেনের সাথে যুক্ত হয়েছে।
আবার একটি সোডিয়াম(Na) পরমাণু একটি এবং কেবল একটি ক্লোরিন(Cl) পরমাণুর সাথে মিলে NaCl (সোডিয়াম ক্লোরাইড) গঠন করে বলে সোডিয়ামের যোজনীও
জারণ সংখ্যা (Oxidation Number):
যৌগ গঠনের সময় কোনো মৌল যত সংখ্যক ইলেকট্রন বর্জন করে ধনাত্বক আয়ন উৎপন্ন করে বা যত সংখ্যক ইলেকট্রন গ্রহণ করে ঋণাত্বক আয়ন উৎপন্ন করে তাকে মৌলের জারণ সংখ্যা বলে। অর্থাৎ যৌগ গঠনের সময় কোনো মৌল যত সংখ্যক ইলেকট্রন বর্জন করে ধনাত্মক আয়ন উৎপন্ন করে বা যত সংখ্যক ইলেকট্রন গ্রহণ করে ঋণাত্বক আয়ন উৎপন্ন করে তাকে মৌলের জারণ সংখ্যা বলে। নিরপেক্ষ বা মুক্ত বা পরমাণু অবস্থায় মৌলের জারণ সংখ্যা শূন্য(০) ধরা হয়। ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে মৌলের জারণ সংখ্যাকে ঋণাত্মক জারণ সংখ্যা এবং ইলেকট্রন বর্জন করেধনাত্মক আয়নে পরিণত হলে একে ধনাত্মক জারণ সংখ্যা বলে।
ধাতু সমুহের জারণ সংখা ধনাত্বক এবং অধাতু সমু্হের জারণ সংখা ঋণাত্বক এবং যৌগ মূলক সমুহের জারণ সংখ্যা তাদের আধান অনুসারে হয়। যৌগ ভেদে অর্থাৎ বিভিন্ন যৌগে একই মৌলের জারণ সংখ্যা ভিন্ন ভিন্ন হতে পারে। যেমন: HCl অণুতে H-এর জারণ সংখ্যা +1 আবার H2 অণুতে এর জারণ সংখ্যা ০। একই ভাবে,HCl অণুতে Cl-এর জারণ সংখ্যা -1 এবং Cl2 অণুতে জারণ সংখ্যা ০। Cu এর জারণ সংখ্যা +2
যোজনী ও জারণ সংখ্যার মধ্যে পার্থক্যঃ
যৌগ গঠনের সময় কোনো মৌল যত সংখ্যক ইলেকট্রন বর্জন করে ধনাত্বক আয়ন উৎপন্ন করে। যোজনী ও জারণ সংখ্যার মধ্যে পার্থক্য নিচে দেখানো হয়েছে-
১। অণু গঠনকালে কোনো মৌলের একটি পরমাণুর সাথে অপর একটি মৌলের কোনো পরমাণু যুক্ত হবার সামর্থ্যকেই যোজনী বলে। যৌগ গঠনের সময় কোনো মৌল যত সংখ্যক ইলেকট্রন বর্জন করে ধনাত্বক আয়ন উৎপন্ন করে বা যত সংখ্যক ইলেকট্রন গ্রহণ করে ঋণাত্বক আয়ন উৎপন্ন করে তাকে মৌলের জারণ সংখ্যা বলে।
২। যোজনী হলো কোন মৌল অপর মৌলের সাথে যুক্ত হওয়ার ক্ষমতা। অন্যদিকে, জারণ সংখ্যা হল, যৌগ গঠনে অংশগ্রহণকৃত মৌলসমূহের ইলেকট্রন আদান-প্রদানের সংখ্যা।
৩। যোজনী সাধারনত স্থির, তবে কিছু মৌলের পরিবর্তনশীল যোজনী রয়েছে। তবুও তা পূর্ব নির্ধারিত থাকে। অন্যদিকে, একই মূলকের ভিন্ন ভিন্ন রাসায়নিক বিক্রিয়া সংঘটনের সময় জারন মান ভিন্ন ভিন্ন হতে পারে।
৪। জারন সংখ্যা ধনাত্বক বা ঋনাত্বক হতে পারে। অন্যদিকে, যোজনী সব সময় ধনাত্বক ।
৫। মৌলের যোজনী সব সময় পূর্ণ সংখ্যা বা শূন্য হতে পারে। যেমনঃ নিষ্ক্রিয় গ্যাসের যোজনী শূন্য হয়। অন্যদিকে, জারণ সংখ্যা পূর্ণসংখ্যা, ভগ্নাংশ বা শূন্য হতে হতে পারে।
৬। যোজনীর উদাহরণ- Cu2SO4 এ Cu এর যোজনী +২ । অন্যদিকে, জারন সংখ্যার উদাহরণ- KMnO4 এ Mn এর জারন মান +৭ ।